水的电离平衡常数为:K==/
水是一个极弱的电解质,它部分地电离为“H+”和“OH-”
并存在着如下的电离平衡:H2O(液傧韭茆鳟)←→H+ + OH-
根据质量作用定律可以把水的电离平衡表示为:[H+]/=K
在25℃时,一升水相当于55.55摩尔水,此时水中所含的[H+]和[OH-]离子浓度各为1.004*10^-7摩尔/升。
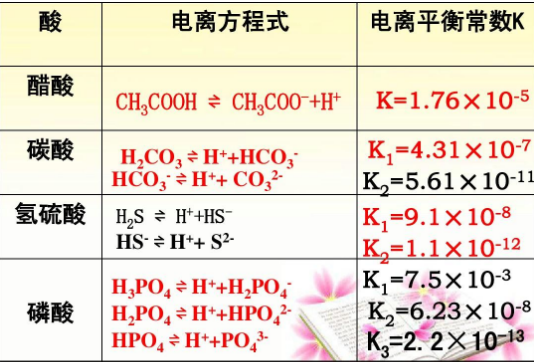
水的电离平衡常数规律:
电离平衡常数的大小反映弱电解质的电离程度,不同温度时有不同的电离常数。
在同一温度下,同一电解质的电离平衡常数相同,但随着弱电解质浓度的降低.转化率会增大。由该温度下的解离度a=(K/起始浓度)的算术平方根,可得知:弱电解质浓度越低电离程度越大。
以上内容参考百度百科—电离平衡常数
